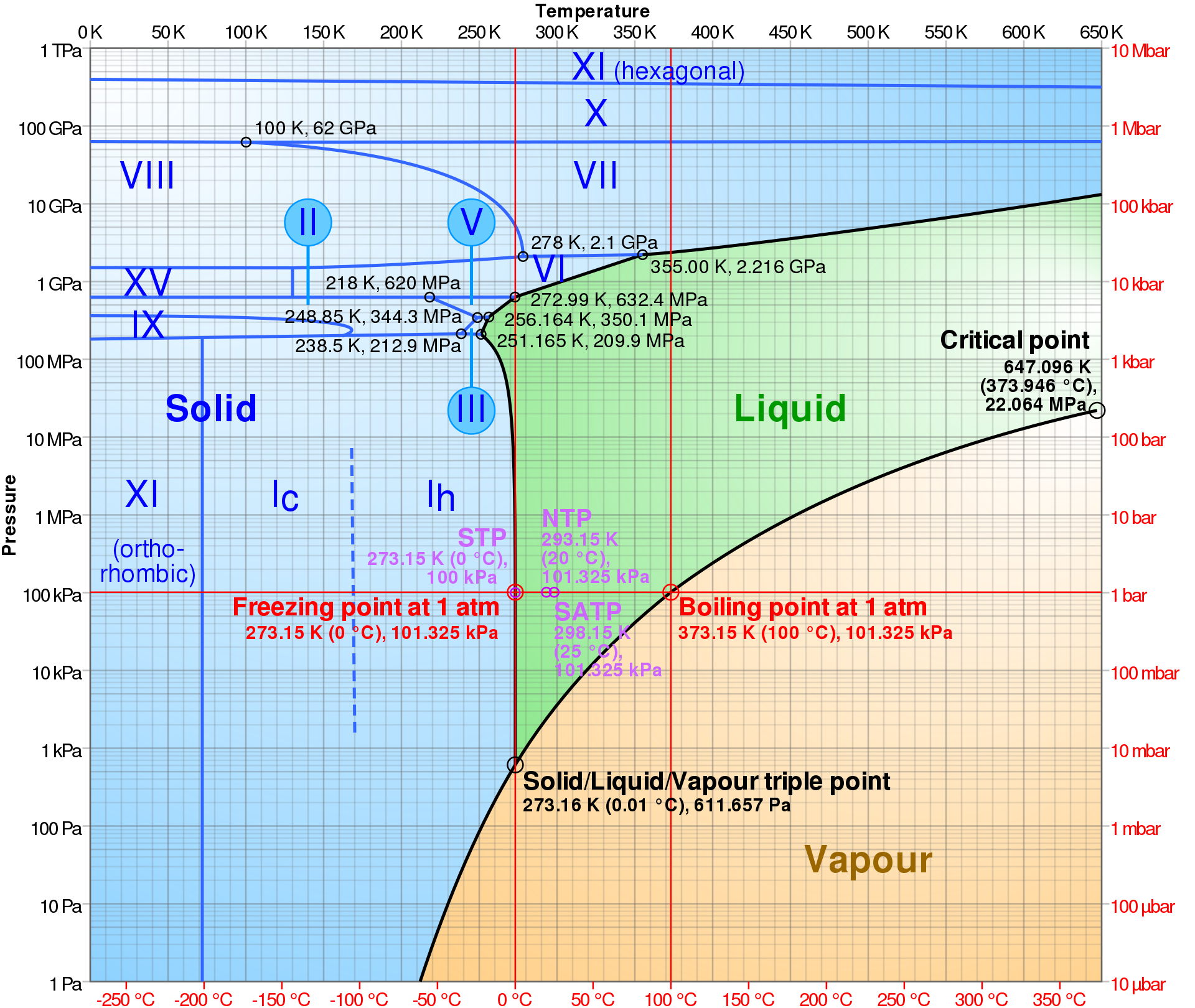
Water is één van de uitzonderlijke moleculen die dichter op elkaar zitten in vaste vorm dan in vloeibare vorm. Dit heeft te maken met de kristalstructuur van ijs of in meer technische termen het feit dat watermoleculen minder waterstofbruggen met elkaar kunnen maken in vaste vorm dan in vloeibare vorm omdat een lagere temperatuur minder energie en dus minder beweging betekent. En deze waterstofbruggen zijn in vloeibaar water juist vrij krachtig en succesvol om de moleculen dicht op elkaar te krijgen. Dus bij een hogere druk en dus het dichter bij elkaar brengen van watermoleculen kan je het (iets langer) vloeibaar maken dus dat is waarom het smeltpunt van ijs lager wordt bij een hogere druk. Dit is ook de reden waarom je op ijs kan schaatsen en waarom ijs glad is. Door de hoge druk maak je een heel klein laagje ijs waar je schaatst op staat vloeibaar waardoor je kan glijden over het ijs. Bij een extreme druk kunnen andere atypische kristalsystemen ontstaan die wel een hogere dichtheid hebben dan de vloeibare vorm. Dat is de reden waarom rond 3000 bar, het punt wanneer het zware type III ijs kan vormen het smeltpunt juist weer stijgt aangezien de vaste vorm nu wel een hogere dichtheid heeft dan de vloeibare vorm. Daarom is het smeltpunt rond die druk het laagst. Als je de druk nog meer verhoogt is beweging van de moleculen vrijwel niet meer mogelijk en is water dus onafhankelijk van de temperatuur bijna altijd alleen in vaste vorm te verkrijgen. Je krijgt dan exotische ijssoorten zoals VII, X en XI (hexagonal) die alleen te vinden zijn in bijvoorbeeld de kernen van ijsmanen of ijsplaneten. Boven 1 - 5 TPa is de druk zo groot dat het niet zoveel zin heeft om het nog 'water' of 'ijs' te noemen aangezien rond die druk molecuulbanden breken en je eigenlijk een soep van atomen hebt in een metaalachtige substantie.